Гипохлорита натрия на 1 куб воды
- для дезинфекции воды в различных плавательных бассейнах и водоемах;
- для обработки природных и сточных вод в системе хозяйственно-питьевого водоснабжения для уничтожения микроорганизмов, устранения запахов;
- в пищевой промышленности для дезинфекции с целью уничтожения ракообразных и моллюсков;
- при обработке бытовых и промышленных сточных вод, для дезинфекции насосных станций, водонапорных башен, канализации и др.
Натрия гипохлорит: что это такое, инструкция по применению, цена, где купить




 Прайс в PDFНаша компания работает на российском рынке по производству реагентов для нефтяной промышленности более 10 лет. Мы начинали в 1991 году в.Гипохлорит натрия является солью хлорноватистой кислоты. Раствор получают заводским способом — поглощением хлора раствором едкого натра. В некоторых отраслях промышленности растворы гипохлоритов являются отходами производств.В соответствии с техническими условиями растворы гипохлорита натрия выпускают трех марок А, Б и В, отличающихся друг от друга по содержанию активного хлора, остаточной щелочности и внешнему виду. Марки А и Б — прозрачные зеленовато-желтые жидкости (допускается взвесь) с содержанием активного хлора 17%.Марка В — жидкость от желтого до коричневого цвета, выпускается I и II сортов, содержащих 12 и 9,5% активного хлора соответственно.На заводах-изготовителях растворы гипохлоритов заливают в стальные гуммированные цистерны или контейнеры, а также в полиэтиленовые канистры или бочки емкостью 20—60 л. Раствор гипохлорита натрия разлагается при хранении, в связи с чем его хранят в закрытом, сухом, прохладном, хорошо проветриваемом нежилом помещении.В виду слабой стойкости раствора гипохлорита и возможных нарушений правил хранения и приготовления рабочих растворов необходимо проводить проверку препаратов и приготовленных рабочих растворов иодометрическим методом на содержание активного хлора. Гипохлорит обладает бактерицидным и спорицидным действием.
Прайс в PDFНаша компания работает на российском рынке по производству реагентов для нефтяной промышленности более 10 лет. Мы начинали в 1991 году в.Гипохлорит натрия является солью хлорноватистой кислоты. Раствор получают заводским способом — поглощением хлора раствором едкого натра. В некоторых отраслях промышленности растворы гипохлоритов являются отходами производств.В соответствии с техническими условиями растворы гипохлорита натрия выпускают трех марок А, Б и В, отличающихся друг от друга по содержанию активного хлора, остаточной щелочности и внешнему виду. Марки А и Б — прозрачные зеленовато-желтые жидкости (допускается взвесь) с содержанием активного хлора 17%.Марка В — жидкость от желтого до коричневого цвета, выпускается I и II сортов, содержащих 12 и 9,5% активного хлора соответственно.На заводах-изготовителях растворы гипохлоритов заливают в стальные гуммированные цистерны или контейнеры, а также в полиэтиленовые канистры или бочки емкостью 20—60 л. Раствор гипохлорита натрия разлагается при хранении, в связи с чем его хранят в закрытом, сухом, прохладном, хорошо проветриваемом нежилом помещении.В виду слабой стойкости раствора гипохлорита и возможных нарушений правил хранения и приготовления рабочих растворов необходимо проводить проверку препаратов и приготовленных рабочих растворов иодометрическим методом на содержание активного хлора. Гипохлорит обладает бактерицидным и спорицидным действием.
5. Наливные люки нужно уплотнить при помощи резиновых прокладок.
Гипохлорит натрия в водоочистке: Практика применения, транспортирования, хранения
Вопрос о качестве воды постоянно обсуждается в газетах и журналах. Согласно информации Всемирной организации здравоохранения, каждый год по всему миру низкое качество воды становится причиной смерти для порядка 5 млн. человек. Инфекции, распространяемые благодаря водоснабжению, приводят к заболеваниям около 500млн.человек ежегодно. Эти данные указывают на необходимость разрешения вопроса о качественном водоснабжении. По этой причине нужно обеспечить население обеззараженной водой, имеющей высокое качество. Вопрос о качестве воды из системы водоснабжения является первоочередным и нуждается в комплексном и эффективном решении. Анализируя ранее используемые метода обеззараживания воды для питья в странах с высоким уровнем развития, можно увидеть, что, к примеру, в Соединенных Штатах Америки 98,6% воды для питья обрабатывается при помощи хлорирования. Озонирование занимает лишь 0,37%, другие способы — 0,25%.Причина подбора именно таких методов заключается в том, что хлорирование является самым эффективным и экономически выгодным способом дезинфекции оды для питья, если сравнивать с другими способами. Тем не менее, этот метод имеет свои недостатки. Согласно с последними данными, ввиду ухудшение качества воды в источниках природного происхождения и роста протяженности труб водоснабжения, которые очищают воду посредством хлорирования, а именно жидкого хлора, увеличивается возможность несчастных случаев, которые приводят к отравлению хлором населения, а также обслуживающего персонала во время его перевозки, хранения, дозирования. Для больших водопроводных станций норма месячного запаса хлора составляет десятки тонн и его сбережения, в частности на станциях, расположенных в черте города, очень небезопасно; причем и на малых водопроводах сбережение даже пары баллонов с хлором может стать опасностью и нуждается в высококвалифицированном обслуживающем персонале. Стоит заметить, что траты на эксплуатацию емкости для сжиженного хлора, как правило, пропорциональны расходам на получение хлора.Данный вопрос можно решить заменив жидкий хлор на другие хлорсодержащие вещества – гипохлорит натрия (ГПХН). Метод дезинфекции воды посредством водного раствора гипохлорита натрия сохраняет все положительные стороны хлорирования и дает возможность не использовать в работе высокотоксичный газ. Хранение и использование этого вещества является полностью безопасным. Он эффективно удаляет множество микроорганизмов, которые приводят к разного рода заболеваниям, окисляет марганец и железо, а также во время его применения водоросли и биообрастиния прекращают свой рост. Его свойством также можно назвать консервирование обеззараживающего эффекта во время продолжительного срока транспортирования воды в системе водоснабжения. Хлораторные станции были переоборудованы специально на гипохлорит натрия, поэтому инспектирующие органы их не контролируют. Следовательно, гипохлорит натрия (марки "А") – это самое лучшее вещество на стадии предварительного окисления, также предназначен для дезинфекции воды под конец обработки перед подачей в систему водоснабжения.Гипохлорит натрия, используемый вместо жидкого хлора для обеззараживания воды для питья, должен соответствовать определенным нормам содержания щелочи, тяжелых металлов, к примеру, железа, цветности, стабильности раствора, концентрации активного хлора. Для системы снабжения питьевой водой данные требования исполняются гипохлоритом натрия марки "А", произведенного на ОАО "ДнепрАЗОТ" г. Днепродзержинска.Как правило, в систему очистки воды гипохлорит натрия поступает после того, как он предварительно был разбавлен водой. После того, как вещество разбавлено в 100 раз снижается уровень рН и содержание активного хлора до 0,125. Если система использует неразбавленный гипохлорит, тогда в подающих трубах появляется осадок, который состоит из диоксида кремния и гидроксида магния, которые препятствуют работе водных каналов. Именно по этой причине, содержание щелочи в гипохлорите должна соответствовать нормам, чтобы не образовывался осадок. Если вода обработана гипохлоритом натрия, тогда вещества, которые входят в состав протоплазмы клеток бактерий, окисляются, что приводит к их гибели. Тем не менее, только небольшая часть хлора, который вводится в воду, применяется для уничтожения бактериальных клеток.Большая часть данного вещества используется для взаимодействия с органическими и неорганическими веществами, которые присутствуют в воде. По этой причине, что сэкономить гипохлорит (в 4-5 раз), лучше всего для дезинфекции воды использовать его исключительно в фильтрованную воду, другими словами, в резервуары чистой воды (РЧВ). В общем, расход гипохлорита для окисления микроорганизмов, органических и минеральных примесей является характеристикой хлорпоглощаемости воды. Поэтому определить дозы ГПХН, нужно для того, чтобы эффективно вести процесс дезинфекции, которые является прямо пропорциональным величине и скорости хлорпоглощения. Стоит заметить, что доза вводимого хлора (ГПХН) должна превышать хлорпоглощаемость на величину остаточного хлора. Это гарантирует то, что окисление бактерий и органических веществ почти завершено.
Обработка бытовых и промышленных сточных водГипохлорит натрия (ГПХН) c успехом используется для очистки воды, используемой в бытовых и промышленных целях. Во время данного процесса уничтожаются животные и растительные микроорганизмы.
Удаляется запах, которые появляется из-за серосодержащих веществ. ГПХН делает безопасными промышленные стоки, к примеру, защищает от цианистых соединений. Это вещество используется для обработки воды, в составе которой есть ион аммония. Реакция проходит при температуре больше 70 0 С в щелочной среде, при этом добавляется СаСl
2 и СаСl
3 для разложения соединений аммиака.С целью очистки фенолов применяют 10-11% раствор гипохлорита натрия, количество которого составляет 3-9 мг/л. Уровень очистки достигает отметки 99,99%. Гуминовые вещества в обрабатываемой сточной воде, превращаются в хлороформы, дихлоруксусную кислоту, трихлоруксусную кислоту, хлоральдегиды и прочие вещества, содержание которых в воде существенно ниже исходной.
Дезинфекция воды плавательных бассейнов и прудовПлавательные бассейны – это объекты, которые предназначены для использования множеством людей, поэтому вода в них должна соответствовать нормам воды для питья.Выполнить эти правила можно при помощи глубокой очистки и дезинфекции циркулирующей воды. Зачастую, для этого безупречно подходят растворы гипохлорита натрия (ГПХН). Цена этих веществ достаточно приемлема, они эффективно выполняют свои функции относительно бактерий и водорослей, а самое важное – это то, что они не наносят вреда обслуживающему персоналу и посетителям бассейна. Вышеперечисленные свойства позволяют использовать эти растворы для очистки воды в быту. Технический ГПХН дает возможность использовать очищенную, прозрачную воду. Он служит гарантией полной дезинфекции воды и защищает ее от загрязнений бактериями..Очистная конструкция бассейнов, как правило, предусматривает: коагуляционную обработку воды, фильтрацию при помощи песчано-антрацитовых фильтров, нагрев, ее подкисливание и хлорирование. Подкисление воды во время хлорирования используется с целью поддержания оптимального уровня рН в пределах 7,2 — 7,8, при которой можно достигнуть наибольшего обеззараживающего эффекта. Обеззараживания высшей степени длительностью 30 минут можно достигнуть во время использования растворов, содержащих 0,1 — 0,2% ГПХН. Уровень остаточного хлора в воде сохраняется на отметке 0,3 — 0,5 мг/л. Концентрация хлора в зоне дыхания не должно быть больше 0,1 мг/м 3 в плавательных бассейнах, предназначенного для использования множеством людей 0,03 мг/м 3 в спортивных бассейнах. Если заменить газообразный хлор на гипохлорит натрия, снизиться выделения хлора в воздухе и, более того, проще будет поддерживать остаточное количество активного хлора в воде.
Если для подкисления используется соляная кислота, в результате выделяется хлор:
Лабораторные методы получения
Основным лабораторным методом получения гипохлорита натрия является пропускание газообразного хлора через охлаждённый насыщенный раствор гидроксида натрия:
C l 2 + 2 N a O H = N a O C l + N a C l + H 2 O <\displaystyle <\mathsf +2NaOH=NaOCl+NaCl+H_<2>O>>>  Для отделения из реакционной смеси хлорида натрия (NaCl) используют охлаждение до температуры близкой к 0 °C — в этих условиях соль выпадает в осадок. Дальнейшим замораживанием смеси (−40 °C) и последующей кристаллизацией при −5 °C получают пентагидрат гипохлорита натрия NaOCl · 5H2O. Безводную соль можно получить обезвоживанием в вакууме над концентрированной серной кислотой.Вместо гидроксида для синтеза можно взять карбонат натрия:
Для отделения из реакционной смеси хлорида натрия (NaCl) используют охлаждение до температуры близкой к 0 °C — в этих условиях соль выпадает в осадок. Дальнейшим замораживанием смеси (−40 °C) и последующей кристаллизацией при −5 °C получают пентагидрат гипохлорита натрия NaOCl · 5H2O. Безводную соль можно получить обезвоживанием в вакууме над концентрированной серной кислотой.Вместо гидроксида для синтеза можно взять карбонат натрия:C l 2 + 2 N a 2 C O 3 + H 2 O = N a O C l + N a C l + 2 N a H C O 3 <\displaystyle <\mathsf +2Na_<2>CO_<3>+H_<2>O=NaOCl+NaCl+2NaHCO_<3>>>>  Водный раствор гипохлорита натрия можно получить обменной реакцией карбоната натрия с гипохлоритом кальция [36] :
Водный раствор гипохлорита натрия можно получить обменной реакцией карбоната натрия с гипохлоритом кальция [36] :C a ( O C l ) 2 + N a 2 C O 3 = 2 N a O C l + C a C O 3 ↓ <\displaystyle <\mathsf +Na_<2>CO_<3>=2NaOCl+CaCO_<3>\!\downarrow >>>  Промышленное производство Мировое производство Оценка мирового объёма производства гипохлорита натрия представляет определённую трудность в связи с тем, что значительная его часть производится электрохимическим способом по принципу "in situ", то есть на месте его непосредственного потребления (речь идёт об использовании соединения для дезинфекции и подготовки воды). По данным на 2005 год, приблизительный глобальный объём производства NaOCl составил около 1 млн тонн, при этом почти половина этого объёма была использована для бытовых, а другая половина — для промышленных нужд. Обзор промышленных способов получения Выдающиеся отбеливающие и дезинфекционные свойства гипохлорита натрия привели к интенсивному росту его потребления, что в свою очередь дало стимул для создания крупномасштабных промышленных производств.В современной промышленности существует два основных метода производства гипохлорита натрия:
Промышленное производство Мировое производство Оценка мирового объёма производства гипохлорита натрия представляет определённую трудность в связи с тем, что значительная его часть производится электрохимическим способом по принципу "in situ", то есть на месте его непосредственного потребления (речь идёт об использовании соединения для дезинфекции и подготовки воды). По данным на 2005 год, приблизительный глобальный объём производства NaOCl составил около 1 млн тонн, при этом почти половина этого объёма была использована для бытовых, а другая половина — для промышленных нужд. Обзор промышленных способов получения Выдающиеся отбеливающие и дезинфекционные свойства гипохлорита натрия привели к интенсивному росту его потребления, что в свою очередь дало стимул для создания крупномасштабных промышленных производств.В современной промышленности существует два основных метода производства гипохлорита натрия:- химический метод — хлорирование водных растворов гидроксида натрия;
- электрохимический метод — электролиз водного раствора хлорида натрия.
В свою очередь, способ химического хлорирования, предлагает две производственные схемы:- основной процесс, где в качестве конечного продукта образуется разбавленный (около 16 % NaOCl) раствор гипохлорита с примесью хлорида и гидроксида натрия;
- низко-солевой или концентрированный процесс — позволяет получить концентрированный (25—40 % NaOCl) с меньшим уровнем загрязнения.
Химический метод Сущность химического метода получения NaOCl не изменилась с момента его открытия ЛабарракомC l 2 + 2 N a O H = N a C l + N a O C l + H 2 O <\displaystyle <\mathsf +2NaOH=NaCl+NaOCl+H_<2>O>>>  Современный химический гигант Dow Chemical Company был одной из первых компаний, поставивших производство гипохлорита натрия на масштабную промышленную основу. В 1898 году открылся первый завод компании по выпуску NaOCl химическим способом. Другой компанией, благодаря которой, это вещество достигло сегодняшней популярности, стала Clorox — крупнейший производитель бытовых отбеливателей в США. С момента основания в 1913 году, вплоть до 1957 года, когда компанию приобрёл концерн Procter & Gamble, отбеливатель на основе гипохлорита натрия Clorox Bleach® был единственным продуктом в её ассортименте.Современная технологическая схема непрерывного производства гипохлорита натрия представлена на рисунке
Современный химический гигант Dow Chemical Company был одной из первых компаний, поставивших производство гипохлорита натрия на масштабную промышленную основу. В 1898 году открылся первый завод компании по выпуску NaOCl химическим способом. Другой компанией, благодаря которой, это вещество достигло сегодняшней популярности, стала Clorox — крупнейший производитель бытовых отбеливателей в США. С момента основания в 1913 году, вплоть до 1957 года, когда компанию приобрёл концерн Procter & Gamble, отбеливатель на основе гипохлорита натрия Clorox Bleach® был единственным продуктом в её ассортименте.Современная технологическая схема непрерывного производства гипохлорита натрия представлена на рисункеНизкосолевой процесс производства, в отличие от основной технологической схемы, представленной выше, включает в себя две стадии хлорирования, причём в кристаллизатор (см. на рисунке), где происходит концентрирование готового продукта, подаётся разбавленный раствор NaOCl из первого реактора
В России товарный гипохлорит натрия производят следующие предприятия:
- "Каустик", ЗАО (Стерлитамак);
- "Каустик", ОАО (Волгоград);
- "Новомосковский хлор", ООО (Новомосковск);
- "Сода-хлорат", ООО (Березники).
Электрохимический метод Электрохимический метод получения гипохлорита натрия заключается в электролизе водного раствора хлорида натрия или морской воды в электролизёре с полностью открытыми электродными зонами (бездиафрагменный способ), то есть продукты электролиза свободно смешиваются в электрохимическом процессе.Процесс на аноде:2 C l − − 2 e − = C l 2 <\displaystyle <\mathsf <2Cl^<->\!\!-2e^<->=Cl_<2>>>>  Процесс на катоде:
Процесс на катоде:
2 H + + 2 e − = H 2 <\displaystyle <\mathsf <2H^<+>+2e^<->=H_<2>>>>  Процесс в электролизёре за счёт химического взаимодействия образующихся продуктов:
Процесс в электролизёре за счёт химического взаимодействия образующихся продуктов:
C l 2 + O H − → e − C l − + H O C l <\displaystyle <\mathsf +OH^<->\ <\xrightarrow >>\ Cl^<->\!+HOCl>>>  Общая схема процесса:
Общая схема процесса:N a C l + H 2 O = N a O C l + H 2 <\displaystyle <\mathsf O=NaOCl+H_<2>>>>  Электрохимический метод используется, в основном, для получения дезинфицирующего раствора для систем водоочистки. Удобство этого метода заключается в том, что производство гипохлорита не требует поставок хлора, его можно производить сразу на месте водоподготовки, избежав, тем самым, расходов на доставку; кроме того, метод позволяет производить гипохлорит в достаточно широком диапазоне объёмов выработки: от очень малых до крупнотоннажных.В мире существуют множество различных производителей электролизёров для получения растворов гипохлорита натрия, среди которых наиболее распространены системы компании Severn Trent De Nora: Seaclor и Sanilec.Система Seaclor ® является преобладающей технологией производства гипохлорита натрия из морской воды электрохимическим методом, занимая свыше 70 % всех мировых мощностей. Более 400 установок Seaclor ® работают в 60 странах; их суммарная производительность составляет порядка 450 тыс. тонн NaOCl в год, единичная мощность колеблется в диапазоне 227—22 680 кг/день. Установки позволяют получать концентрацию активного хлора в растворе в диапазоне 0,1—0,25 %.Установки Sanilec ® выпускаются производительностью от 1,2 (портативные генераторы) до 21 600 кг/день, концентрация активного хлора составляет 0,05—0,25 %. Характеристика продукции, обращение, хранение и транспортировка В Российской Федерации гипохлорит натрия выпускается в соответствии с ГОСТ 11086-76 "Гипохлорит натрия. Технические условия". В соответствии с этим документом, по назначению NaOCl делится на две марки, характеристики которых представлены ниже:
Электрохимический метод используется, в основном, для получения дезинфицирующего раствора для систем водоочистки. Удобство этого метода заключается в том, что производство гипохлорита не требует поставок хлора, его можно производить сразу на месте водоподготовки, избежав, тем самым, расходов на доставку; кроме того, метод позволяет производить гипохлорит в достаточно широком диапазоне объёмов выработки: от очень малых до крупнотоннажных.В мире существуют множество различных производителей электролизёров для получения растворов гипохлорита натрия, среди которых наиболее распространены системы компании Severn Trent De Nora: Seaclor и Sanilec.Система Seaclor ® является преобладающей технологией производства гипохлорита натрия из морской воды электрохимическим методом, занимая свыше 70 % всех мировых мощностей. Более 400 установок Seaclor ® работают в 60 странах; их суммарная производительность составляет порядка 450 тыс. тонн NaOCl в год, единичная мощность колеблется в диапазоне 227—22 680 кг/день. Установки позволяют получать концентрацию активного хлора в растворе в диапазоне 0,1—0,25 %.Установки Sanilec ® выпускаются производительностью от 1,2 (портативные генераторы) до 21 600 кг/день, концентрация активного хлора составляет 0,05—0,25 %. Характеристика продукции, обращение, хранение и транспортировка В Российской Федерации гипохлорит натрия выпускается в соответствии с ГОСТ 11086-76 "Гипохлорит натрия. Технические условия". В соответствии с этим документом, по назначению NaOCl делится на две марки, характеристики которых представлены ниже:| Наименование показателя | Марка А | Марка Б |
|---|
| Внешний вид | Жидкость зеленовато-жёлтого цвета |
| Коэффициент светопропускания | Не менее 20 % |
| Массовая концентрация активного хлора, г/дм³, не менее | 190 | 170 |
| Массовая концентрация щёлочи в пересчёте на NaOH, г/дм³ | 10—20 | 40—60 |
| Массовая концентрация железа, г/дм³, не более | 0,02 | 0,06 |
| Область применения | В химической промышленности для обеззараживания воды, дезинфекции и отбелки | В витаминной промышленности (как окислитель) и для отбеливания ткани |
Гипохлорит натрия должен храниться в защищённых от света, специальных полиэтиленовых, стальных гуммированных или других, покрытых коррозионно-стойкими материалами ёмкостях, наполненных на 90 % объёма и оборудованных воздушником для сброса образующегося при распаде кислорода. Перевозка продукции осуществляется в соответствии с правилами транспортировки опасных грузов.Растворы товарного гипохлорита натрия со временем теряют свою активность из-за разложения NaOCl. Следующая таблица наглядно показывает, что с течением времени концентрация активного вещества в растворах уменьшается. Тем не менее, как видно из полученной диаграммы, с уменьшением концентрации гипохлорита скорость его распада также уменьшается и промышленные растворы стабилизируются:| Концентрация NaOCl, % | Период полуразложения, дней |
|---|
| 25 °C | 35 °C |
|---|
| 15 | 144 | 39 |
| 12 | 180 | 48 |
| 9 | 240 | 65 |
| 6 | 360 | 97 |
| 3 | 720 | 194 |
| 1 | 2160 | 580 |
Наиболее стабильны для хранения водные растворы гипохлорита, имеющие pH в диапазоне 11,86−13.Применение Водный растворр гипохлорита натрия применяют при дезинфекции, так как обладает высокой антибактериальной активностью при воздействия на разные микроорганизмы.Гипохлорит натрия используется для: - для обработки питьевой воды и воды бассейнов для плавания;
- в химической пром-сти для производства средств для отбеливания;
- для дезинфекции сточных вод;
- как окислитель при отбеливании тканей;
- для обеззараживания воды рыбохозяйственных водоёмов, так как раствор гипохлорит анатрия убивает все виды болезнетворных агентов;
- для обработки помещений на предприятиях общепита и в медучреждениях;
У соединения известно три кристаллогидрата:
Физические свойства
Безводный гипохлорит натрия представляет собой неустойчивое бесцветное кристаллическое вещество. Элементный состав: Na (30,9 %), Cl (47,6 %), O (21,5 %).Хорошо растворим в воде: 53,4 г в 100 граммах воды (130 г на 100 г воды при 50 °C) [9] .У соединения известно три кристаллогидрата:- моногидрат NaOCl · H2O — крайне неустойчив, разлагается выше 60 °C, при более высоких температурах — со взрывом [3] .
- NaOCl · 2,5H2O — более устойчив, плавится при 57,5 °C [3] .
- пентагидрат NaOCl · 5H2O — наиболее устойчивая форма, представляет собой бледно-зеленовато-жёлтые (технического качества — белые [10] ) ромбические кристаллы (a = 0,808 нм, b = 1,606 нм, c = 0,533 нм, Z = 4). Не гигроскопичен, хорошо растворим в воде (в г/100 граммов воды, в пересчёте на безводную соль): 26 (−10 °C), 29,5 (0 °C), 38 (10 °C), 82 (25 °C), 100 (30 °C). В воздухе расплывается, переходя в жидкое состояние, из-за быстрого разложения [3] . Температура плавления: 24,4 °C (по другим данным: 18 °C [10] ), при нагревании (30—50 °C) разлагается [1] .
Плотность водного раствора гипохлорита натрия при 18 °C [11] :| 1 % | 2 % | 4 % | 6 % | 8 % | 10 % | 14 % |
|---|
| Плотность, г/л | 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 |
| 18 % | 22 % | 26 % | 30 % | 34 % | 38 % | 40 % |
|---|
| 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Температура замерзания водных растворов гипохлорита натрия различных концентраций [12] :[стр. 458] :| 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % |
|---|
| Температура замерзания, °C | −1,0 | −2,2 | −4,4 | −7,5 | −10,0 | −13,9 | −19,4 | −29,7 |
Термодинамические характеристики гипохлорита натрия в бесконечно разбавленном водном растворе [13] :Разложение гипохлоритов в водных растворах зависит от кислотности раствора и его температуры. В сильнокислых средах при рН ≤ 3 хлорноватистая кислота при комнатной температуре разлагается до хлора и кислорода
Способы получения наиболее важных товарных продуктов
Крупнотоннажными гипохлоритсодержащими продуктами являются гипохлорит натрия и гипохлорит кальция. Их глобальный объем производства превышает 1 млн тонн/год. При этом почти половина этого объема используется в быту, а другая половина в промышленности. Гипохлорит калия, являющийся исторически первым гипохлоритом, нашедшим промышленное применение, производится в ограниченном количестве.Для промышленного производства гипохлорита натрия используются химический и электрохимический методы. При химическом методе производится хлорирование водных растворов гидроксида натрия. Суть химического превращения не изменилась со времен его открытия и применения ЛабарракомCl 2 + 2NaOH = NaClO + NaCl + H 2 O.Существуют две производственные схемы данного метода:- основной процесс, в результате которого производится 16%-ный раствор гипохлорита натрия в смеси с хлоридом натрия и гидроксидом натрия (рис. 4).
- низко-солевой или концентрированный процесс позволяет получить концентрированные растворы (25–40%) гипохлорита натрия с меньшим содержанием примесей. Его отличие от основного способа заключается в добавлении второй стадии хлорирования. Во второй реактор подается не гидроксид натрия, а раствор гипохлорита натрия из первого реактора, в результате происходит концентрирование готового продукта (рис. 5).
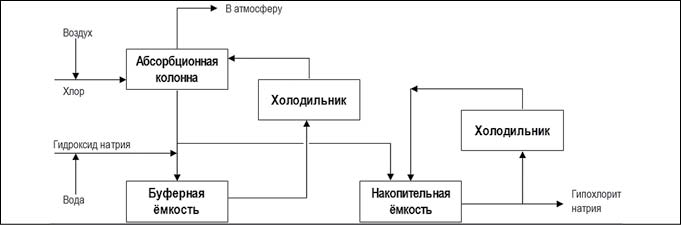
Рис. 4. Химический метод получения гипохлорита натрия основным процессом (рис. с сайта https://ru.wikipedia.org)
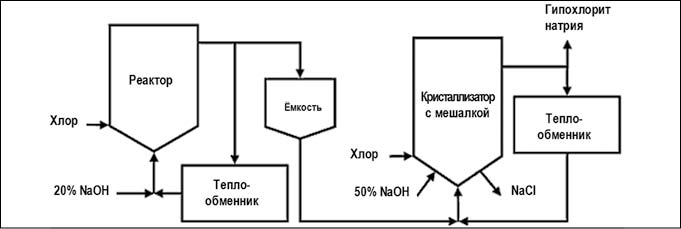
Рис. 5. Химический метод получения гипохлорита натрия концентрированным процессом (рис. с сайта https://ru.wikipedia.org)При электрохимическом методе получения гипохлорита натрия водный раствор хлорида натрия подвергается электролизу в электролизере с открытыми электродными зонами (бездиафрагменный способ). Гидроксид натрия, образующийся на катоде, и хлор, выделяющийся на аноде, беспрепятственно смешиваются в ходе электрохимического процессаNaCl + H 2 O = NaClO + H 2 ↑(суммарная реакция).Гипохлорит кальция производится в виде хлорной извести, представляющей собой смесь целевого продукта с хлоридом кальция и гидроксидом кальция. В качества сырья для получения хлорной извести используется порошкообразный гидроксид кальция (пушенка), содержащий менее 1% свободной влаги и разбавленный влажным воздухом хлор. Небольшая влажность исходных веществ обеспечивает начало реакции гидролиза хлора, сопровождающейся нейтрализацией образующихся кислот известью. Затем реакция продолжается за счет воды, выделяющейся из гидроксида кальция при хлорировании2Сa(OH) 2 + 2Cl 2 = Сa(ClO) 2 + СaCl 2 + 2H 2 O (суммарно).Хлорирование пушенки осуществляется в аппаратах непрерывного действия – механических полочных камерах Бакмана.Таблица 4. Производители гипохлорита натрия в России.
| Название предприятия | Сайт предприятия |
|---|
| "Каустик" ЗАО, г. Стерлитамак | www.kaus.ru/ |
| "Каустик" ОАО, г. Волгоград | www.kaustik.ru/ |
| "Новомосковский хлор" ООО, г. Новомосковск | www.hlor.biz/ |
| "Сода-хлорат" ООО, г. Березняки | www.soda.perm.ru/ |




 Прайс в PDFНаша компания работает на российском рынке по производству реагентов для нефтяной промышленности более 10 лет. Мы начинали в 1991 году в.Гипохлорит натрия является солью хлорноватистой кислоты. Раствор получают заводским способом — поглощением хлора раствором едкого натра. В некоторых отраслях промышленности растворы гипохлоритов являются отходами производств.В соответствии с техническими условиями растворы гипохлорита натрия выпускают трех марок А, Б и В, отличающихся друг от друга по содержанию активного хлора, остаточной щелочности и внешнему виду. Марки А и Б — прозрачные зеленовато-желтые жидкости (допускается взвесь) с содержанием активного хлора 17%.Марка В — жидкость от желтого до коричневого цвета, выпускается I и II сортов, содержащих 12 и 9,5% активного хлора соответственно.На заводах-изготовителях растворы гипохлоритов заливают в стальные гуммированные цистерны или контейнеры, а также в полиэтиленовые канистры или бочки емкостью 20—60 л. Раствор гипохлорита натрия разлагается при хранении, в связи с чем его хранят в закрытом, сухом, прохладном, хорошо проветриваемом нежилом помещении.В виду слабой стойкости раствора гипохлорита и возможных нарушений правил хранения и приготовления рабочих растворов необходимо проводить проверку препаратов и приготовленных рабочих растворов иодометрическим методом на содержание активного хлора. Гипохлорит обладает бактерицидным и спорицидным действием.
Прайс в PDFНаша компания работает на российском рынке по производству реагентов для нефтяной промышленности более 10 лет. Мы начинали в 1991 году в.Гипохлорит натрия является солью хлорноватистой кислоты. Раствор получают заводским способом — поглощением хлора раствором едкого натра. В некоторых отраслях промышленности растворы гипохлоритов являются отходами производств.В соответствии с техническими условиями растворы гипохлорита натрия выпускают трех марок А, Б и В, отличающихся друг от друга по содержанию активного хлора, остаточной щелочности и внешнему виду. Марки А и Б — прозрачные зеленовато-желтые жидкости (допускается взвесь) с содержанием активного хлора 17%.Марка В — жидкость от желтого до коричневого цвета, выпускается I и II сортов, содержащих 12 и 9,5% активного хлора соответственно.На заводах-изготовителях растворы гипохлоритов заливают в стальные гуммированные цистерны или контейнеры, а также в полиэтиленовые канистры или бочки емкостью 20—60 л. Раствор гипохлорита натрия разлагается при хранении, в связи с чем его хранят в закрытом, сухом, прохладном, хорошо проветриваемом нежилом помещении.В виду слабой стойкости раствора гипохлорита и возможных нарушений правил хранения и приготовления рабочих растворов необходимо проводить проверку препаратов и приготовленных рабочих растворов иодометрическим методом на содержание активного хлора. Гипохлорит обладает бактерицидным и спорицидным действием.








