Определение тиомочевины в сточных водах
Определение тиомочевины в сточных водах

В горнодобывающем направлении, пожалуй, в наибольшей степени, ценны хим. свойства тиокарбамида. Здесь он выполняет роль флотационного средства для различных металлов. Это также отличный реагент, который приходит на помощь в поисках Bi, Re, Os и Ru. С его помощью производят синтетические смолы и рассоединяют парафины.
Тиомочевина: свойства, формула, области применения

 Тиомочевина (тиокарбамид) – это твердое белое вещество, сформированное кристаллическими компонентами ромбической сингонии. По сути, является диамидом тиоугольной к-ты. Вкус имеет горький. При стремительном нагреве, достигая температуры 180-182 °C, плавится, а нагреваясь постепенно и неспешно, разлагается. В таких средах, как вода, метиловый спирт и пиридин, растворению поддается в средней степени, в 50 % H2O р-воре пиридина растворяется хорошо, в этоксиэтане – плохо. В бензоле и четыреххлористом углероде не растворимо.Молярная масса – 76,12 г/моль, плотность – 1,405 г/см 3 (при 20 °C). Термосвойства: t плавления – 176 °C, t разложения – 200 °C. Формула: CH4N2S.
Тиомочевина (тиокарбамид) – это твердое белое вещество, сформированное кристаллическими компонентами ромбической сингонии. По сути, является диамидом тиоугольной к-ты. Вкус имеет горький. При стремительном нагреве, достигая температуры 180-182 °C, плавится, а нагреваясь постепенно и неспешно, разлагается. В таких средах, как вода, метиловый спирт и пиридин, растворению поддается в средней степени, в 50 % H2O р-воре пиридина растворяется хорошо, в этоксиэтане – плохо. В бензоле и четыреххлористом углероде не растворимо.Молярная масса – 76,12 г/моль, плотность – 1,405 г/см 3 (при 20 °C). Термосвойства: t плавления – 176 °C, t разложения – 200 °C. Формула: CH4N2S.
Реагирование
Тиомочевина вступает в реакции с большим перечнем реактивов, в результате чего образуются новые соединения. В сочетании с минеральными кислотами она приводит к формированию солей, с солями некоторых металлов, к примеру, цинка, никеля, кобальта и др. – соединений-комплексов, с рядом спиртов (фенилкарбинолом, альфафуранкарбинолом) при наличии хлористоводородной кислоты – S-алкилпроизводных. Если обеспечить ее взаимодействие с оксиранами, сформируются тиираны, с нитритами металлов при участии кислот – родановодородная к-та или формамидин дисульфид (зависимо от уровня pH), с хлористым ацетилом – S-ацетилизотиомочевина. И это далеко не все возможные реакции. На тиокарбамид можно воздействовать также следующими материалами:— дихлордисульфаном в метилтрихлориде (в результате появляется дигидрохлорид формамидинтрисульфида);— оксидом ртути в H2O или эфире (формируется цианамид);— пероксидом водорода при условии нейтральности среды (на выходе образуется формамидинсульфоновая к-та);— альдегидами или кетонами (появляются гидроксиалкилмочевины, которые в случае отсоединения от них воды становятся N-тиокарбамоилиминами).Заслуживают внимания и реакции, происходящие при нагреве данного вещества. Если длительно поддерживать температуру 130 °C, то происходит трансформация в тиоцианит аммония. Достижение 200 °C приводит к формированию ряда продуктов, среди которых: цианамид, дисульфид углерода, нитрид водорода и др. Совместный нагрев со щелочами – основа для гидролиза до аммиака, дигидросульфида и углекислоты, а умеренный вместе с ангидридом уксусной кислоты – для появления N-ацетилтиомочевины.Также для рассматриваемого вещества характерна реакция S-арилирования (происходит, если задействовать активированные арилгалогениды/соли арилдиазония).Получение
Для образования тиомочевины, как правило, берут тиоциановокислый аммоний и превращают его в изомер при t 170 °С. Но это не единственно возможный способ синтеза данного соединения. Также получить его можно, по классике жанра, синтезируя цианат аммония по методу Велера. И еще один вариант: в ходе синтеза нитрида водорода и углерода (IV) сульфида. 98 % тиокарбамид при t 130 °С, которая воздействует на него продолжительное время, становится опять роданидом аммония.Применение
Данный продукт востребован в различных отраслях. Давайте рассмотрим основные из них.В горнодобывающем направлении, пожалуй, в наибольшей степени, ценны хим. свойства тиокарбамида. Здесь он выполняет роль флотационного средства для различных металлов. Это также отличный реагент, который приходит на помощь в поисках Bi, Re, Os и Ru. С его помощью производят синтетические смолы и рассоединяют парафины.Особая значимость отмечается в функционировании добывающих золото комбинатов, где с помощью рассматриваемого продукта производят восстановление Au и Ag. Как именно? Содержащие золото и серебро смолы десорбируют. Тиомечевина способна осадить золото при реализации некоторых реакций: цементации (благородный металл вытесняют при помощи Pb, Al или Zn), осаждении щелочью и электролизе с анодами, не поддающимися растворению. Самым инновационным является последний процесс. Когда совокупность многих компонентов проходит сквозь регенерат постоянного тока, происходит восстановление на катоде золота и серебра.Тиокарбамид задействуют в электролитическом блестящем золочении (является составляющей одного из самых популярных электролитов для гальванозолочения). Кроме того, он задействуем в хим. лужении медных изделий и деталей из сплавов на основе данного металла. С его участием, а также с задействованием нитрата свинца и каустического поташа, на PbS наносят полупроводниковую пленку при t 45-60 °C. Рабочий раствор в данном процессе характеризуется разовостью применения. Работу могут затруднить такие факторы, как высокая t и точные размерные параметры моделей.Не переоценить значение тиомочевины и для сельского хозяйства. Это ценнейшее удобрение неорганической этимологии и эффективный фунгицид (средство для борьбы с грибками растений). Без него часто не обходятся, если почва сильно заражена нематодой картофельной (внесение в почвенные пласты производят при перекопке). Если необходимо антисептировать посадочный материал, в тиомочевинном растворе, приготовленном в пропорции 5 г/л следует замочить клубни на ¾ суток. Даже если клубни больны, благодаря тиокарбамиду, они станут здоровыми. К слову, производные этого вещества могут применяться дополнительно как гербициды, зооциды и инсектициды.Также водные растворы данного реактива с концентрацией 500 миллиграммов на килограмм способны минимизировать или тормозить потемнения и микробиальную порчу плодов (действуют больше на плесень, меньше на бактерии). Но, обратите внимание, что применение данного материала в пищепроме, а следовательно и введение его в любые продукты питания, запрещено. Этот консервант является сильнейшим канцерогеном, осуществляет большое токсическое воздействие на человеческий организм и блокирует работу щитовидки. Хотя в свое время его использовали для предотвращения преждевременной порчи цитрусовых.Где еще применяем данный химикат? В текстильном производстве, металлургической индустрии, электронной промышленности, фармацевтической отрасли, медицине и др. Без него не обходится органический синтез (создание алифатических тиолов и гетероциклов). Из него производят лекарства, в частности сульфидин. Он выступает хорошим ингибитором кислотных коррозионных проявлений на сталях.Вместо заключения. В каком бы из упомянутых направлений вам не понадобилось использовать тиокарбамид, помните: ему присвоен шестой класс опасности, а допустимая концентрация в воздушном пространстве составляет 0,3 мг/м. Используйте при работе спецодежду, респиратор, очки и перчатки. Храните, перевозите и применяйте этот продукт с осторожностью, согласно предписаниям технической документации.
Тиомочевину используют для лужения меди, а также в процессе производства полупроводниковой пленки из свинца. Тиомочевина также широко используется в синтезе гетероциклических соединений, а также в качестве ингибитора кислотной коррозии сталей.
Применение
- на горнодобывающих комбинатах (в т.ч. золотодобыча);
- в текстильной промышленности;
- в металлургии
- в фармацевтике.
Применение тиомочевины в пиротехнике
Используется как низкокалорийное горючее-активатор в цветопламенных и сигнальных дымовых составах.Способна облегчать воспламенение и интенсифицировать сгорание пиротехнических смесей.
- кислотность;
- токсичность;
- прозрачность;
- взвешенный остаток.
Государственное регулирование водного баланса
Существует ряд принятых на государственном уровне ГОСТов по качеству питьевой воды, а также нормы стоков и предельно допустимых концентраций загрязняющих веществ.При осуществлении производственной деятельности разрабатываются паспорта водного хозяйства, в том числе для учёта факторов риска: в них учитывается не только баланс водопотребления и водоотведения, источники водоснабжения, но и возможные загрязняющие вещества, а также их предельно допустимые концентрации и способы очистки.Анализ воды сточных вод является обязательным при проведении хозяйственной деятельности, а также для предприятий, занимающихся очисткой воды: им необходимо периодически проверять качество стоков, поступающих на очистные сооружения.
Тиомочевина реагирует с бифункциональными электрофилами, образуя гетероциклические соединения. Так, например, с α-галогенкетонами тиомочевина (и её N-замещенные производные)образует 2-аминотиазолы:
Реакционная способность
Структура молекулы тиомочевины может быть представлена мезомерными канонической тиоамидной формой и тиоимидными формами, несущими отрицательный заряд на атоме серы и положительный на атомах азота амидинового фрагмента: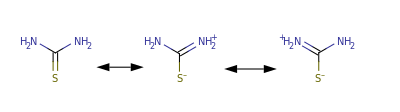 В результате атом серы является сильным нуклеофильным центром и тиомочевина протонируется по атому серы с образованием солей с сильными кислотами. Атаки мягких электрофилов также направляются на атом серы: тиомочевина алкилируется алкилгалогенидами и алкилсульфатами с образованием изотиурониевых солей:
В результате атом серы является сильным нуклеофильным центром и тиомочевина протонируется по атому серы с образованием солей с сильными кислотами. Атаки мягких электрофилов также направляются на атом серы: тиомочевина алкилируется алкилгалогенидами и алкилсульфатами с образованием изотиурониевых солей:
 Аналогично протекает реакция тиомочевины с арилдиазониевыми солями.S-алкилирование тиомочевины также является первой стадией её взаимодействия с эпоксидами, ведущего к образованию тииранов (эписульфидов) [2] :
Аналогично протекает реакция тиомочевины с арилдиазониевыми солями.S-алкилирование тиомочевины также является первой стадией её взаимодействия с эпоксидами, ведущего к образованию тииранов (эписульфидов) [2] :
 Ацилирование тиомочевины галогенангидридами и ангидридами карбоновых кислот, в зависимости от условий реакции, может протекать как по сере (в мягких условиях), так и по азоту (в жестких условиях).Альдегиды и кетоны с присоединяются к тиомочевине, образуя гидроксиалкилтиомочевины, которые при отщеплении воды превращаются в N-тиокарбамоилимины:
Ацилирование тиомочевины галогенангидридами и ангидридами карбоновых кислот, в зависимости от условий реакции, может протекать как по сере (в мягких условиях), так и по азоту (в жестких условиях).Альдегиды и кетоны с присоединяются к тиомочевине, образуя гидроксиалкилтиомочевины, которые при отщеплении воды превращаются в N-тиокарбамоилимины:
H2NC(S)NH2 + R2CO → <\displaystyle \to > 

 при взаимодействии с 1,3-дикарбонильными соединениями — 2-меркаптопиримидины:
при взаимодействии с 1,3-дикарбонильными соединениями — 2-меркаптопиримидины:


Проверка проводится согласно требованиям, которые определяют следующие документы:
Регламентирующие документы
Анализ сточных вод — это обязательная процедура, которую должны выполнять промышленные предприятия, Водоканал и городские подразделения СЭС.Проверка проводится согласно требованиям, которые определяют следующие документы:- Общие природоохранные нормативы. Документы, определяющие деятельность по охране водных ресурсов;
- СанПиН 2.1.7.573-96. Свод санитарных нормативов, регламентирующих качество и состав сточных вод;
- ГОСТ 31861 2012 «Вода. Общие требования к отбору проб». Государственный стандарт, определяющий все аспекты отбора проб, технические моменты, условия их хранения и консервации;
- МУ 2.1.5.800-99. Это методические указания по обеззараживанию сточных вод, изданные Госсанэпиднадзором. Содержат перечень мероприятий, правила и сроки их выполнения.

Алкилирование тиомочевины используется алкилирование с образованием алкилтиурониевых солей и их последующим щелочным гидролизом: используется как препаративный метод синтеза алифатических тиолов:
Реакционная способность
Структура молекулы тиомочевины может быть представлена мезомерными канонической тиоамидной формой и тиоимидными формами, несущими отрицательный заряд на атоме серы и положительный на атомах азота амидинового фрагмента:  В результате атом серы является сильным нуклеофильным центром и тиомочевина протонируется по атому серы с образованием солей с сильными кислотами. Атаки мягких электрофилов также направляются на атом серы: тиомочевина алкилируется алкилгалогенидами и алкилсульфатами с образованием изотиурониевых солей:
В результате атом серы является сильным нуклеофильным центром и тиомочевина протонируется по атому серы с образованием солей с сильными кислотами. Атаки мягких электрофилов также направляются на атом серы: тиомочевина алкилируется алкилгалогенидами и алкилсульфатами с образованием изотиурониевых солей:
 Аналогично протекает реакция тиомочевины с арилдиазониевыми солями.S-алкилирование тиомочевины также является первой стадией её взаимодействия с эпоксидами, ведущего к образованию тииранов (эписульфидов):
Аналогично протекает реакция тиомочевины с арилдиазониевыми солями.S-алкилирование тиомочевины также является первой стадией её взаимодействия с эпоксидами, ведущего к образованию тииранов (эписульфидов):
 Ацилирование тиомочевины галогенангидридами и ангидридами карбоновых кислот, в зависимости от условий реакции, может протекать как по сере (в мягких условиях), так и по азоту (в жестких условиях).Альдегиды и кетоны с присоединяются к тиомочевине, образуя гидроксиалкилтиомочевины, которые при отщеплении воды превращаются в N-тиокарбамоилимины:
Ацилирование тиомочевины галогенангидридами и ангидридами карбоновых кислот, в зависимости от условий реакции, может протекать как по сере (в мягких условиях), так и по азоту (в жестких условиях).Альдегиды и кетоны с присоединяются к тиомочевине, образуя гидроксиалкилтиомочевины, которые при отщеплении воды превращаются в N-тиокарбамоилимины:
H2NC(S)NH2 + R2CO H2NC(S)NHC(OH)R2 H2NC(S)NHC(OH)R2
H2NC(S)N=CR2 Тиомочевина реагирует с бифункциональными электрофилами, образуя гетероциклические соединения. Так, например, с α-галогенкетонами тиомочевина (и её N-замещенные производные)образует 2-аминотиазолы:
 при взаимодействии с 1,3-дикарбонильными соединениями — 2-меркаптопиримидины:
при взаимодействии с 1,3-дикарбонильными соединениями — 2-меркаптопиримидины:


Гидрофобные коллоиды не растворяются в воде, не взаимодействуют с молекулами воды и являются типичными коллоидными системами. Они неустойчивы и постепенно разрушаются, выделяя дисперсную фазу при укрупнении частиц под действием межмолекулярных сил сцепления, переходя в I группу примесей.В І группу включены взвеси (взвешенные вещества, грубодисперсные примеси). К ним относятся: мелкий песок, ил, глинистые вещества, зола, окалина, пищевые остатки, гидроксиды металлов и другие, т.е. такие примеси, которые удерживаются во взвешенном состоянии динамическими силами потоков воды; в состоянии покоя они оседают (если плотность больше плотности воды) или всплывают (при плотности меньше единицы).

 В природные воды взвеси попадают вследствие размывания пород русла, смыва почв ливневыми водами. В сточные воды взвеси поступают из санитарных приборов (остатки пищи, частицы почвы) или в результате технологических процессов (например, окалина при охлаждении валков прокатных станов, частицы угля в шахтных водах). Взвеси антропогенного происхождения имеют повышенную устойчивость к оседанию.Взвешенные вещества могут содержать на своей поверхности бактерии, вирусы, ядохимикаты, радионуклиды.К I группе примесей относятся также планктон и бактерии. Бактерии могут быть безвредными для организма человека и болезнетворными. Они не выпадают в осадок и не всплывают в неподвижной воде, а находятся либо в свободном состоянии, либо на поверхности взвешенных веществ. Последний вариант встречается чаще. Бактерии распространяются водным путем.Планктон принято подразделять на зоопланктон (рачки, черви) и фитопланктон (водоросли). Первые активно перемещаются в воде. Водоросли интенсивно развиваются в теплое время года в малоподвижной воде (в водохранилищах). Самые распространенные в наших климатических условиях — сине-зеленые водоросли.Более общее название II группы примесей (коллоидов) — золи (при дисперсионной среде в виде воды — гидрозоли). Поскольку частицы коллоидов всего на порядок больше молекул, золи называют еще микрогетерогенными системами; они занимают промежуточное положение между суспензиями и истинными растворами (говорят еще о коллоидных растворах). Различают гидрофобные и гидрофильные коллоиды.
В природные воды взвеси попадают вследствие размывания пород русла, смыва почв ливневыми водами. В сточные воды взвеси поступают из санитарных приборов (остатки пищи, частицы почвы) или в результате технологических процессов (например, окалина при охлаждении валков прокатных станов, частицы угля в шахтных водах). Взвеси антропогенного происхождения имеют повышенную устойчивость к оседанию.Взвешенные вещества могут содержать на своей поверхности бактерии, вирусы, ядохимикаты, радионуклиды.К I группе примесей относятся также планктон и бактерии. Бактерии могут быть безвредными для организма человека и болезнетворными. Они не выпадают в осадок и не всплывают в неподвижной воде, а находятся либо в свободном состоянии, либо на поверхности взвешенных веществ. Последний вариант встречается чаще. Бактерии распространяются водным путем.Планктон принято подразделять на зоопланктон (рачки, черви) и фитопланктон (водоросли). Первые активно перемещаются в воде. Водоросли интенсивно развиваются в теплое время года в малоподвижной воде (в водохранилищах). Самые распространенные в наших климатических условиях — сине-зеленые водоросли.Более общее название II группы примесей (коллоидов) — золи (при дисперсионной среде в виде воды — гидрозоли). Поскольку частицы коллоидов всего на порядок больше молекул, золи называют еще микрогетерогенными системами; они занимают промежуточное положение между суспензиями и истинными растворами (говорят еще о коллоидных растворах). Различают гидрофобные и гидрофильные коллоиды.

 Гидрофобные коллоиды не растворяются в воде, не взаимодействуют с молекулами воды и являются типичными коллоидными системами. Они неустойчивы и постепенно разрушаются, выделяя дисперсную фазу при укрупнении частиц под действием межмолекулярных сил сцепления, переходя в I группу примесей.Гидрофильные коллоиды взаимодействуют с дисперсной средой и способны растворяться в ней. Фактически они представляют собой устойчивые растворы высокомолекулярных соединений с молекулярной массой 104–106 единиц.Коллоидные примеси природных вод представляют собой минеральные и органоминеральные частицы почв и грунтов, недиссоциированные и нерастворимые формы гумуса. Гумус вымывается из лесных, болотистых и торфяных почв или образуется в водоемах в результате жизнедеятельности растений и водорослей. Коллоиды содержатся также в большинстве сточных вод, особенно в стоках нефтехимических и целлюлозно-бумажных производств.Примеси коллоидной дисперсности имеют высокую удельную поверхность и обладают большой поверхностной энергией. С увеличением степени дисперсности растет количество молекул, находящихся на поверхности раздела фаз. Они расположены в несимметричном силовом поле и обладают избыточной свободной энергией из-за некомпенсированных молекулярных связей.Ко II группе примесей Кульский относит и вирусы. Они не способны существовать на питательных средах и размножаются только в клетках организма-хозяина.III группу примесей представляют органические соединения биологического и антропогенного происхождения — жиры, белки, углеводы, сахара, продукты жизнедеятельности бактерий, водорослей, человека и животных), фенолы, спирты, альдегиды и тому подобное, стоки химической промышленности, растворимые формы гумуса (фульвокислоты).
Гидрофобные коллоиды не растворяются в воде, не взаимодействуют с молекулами воды и являются типичными коллоидными системами. Они неустойчивы и постепенно разрушаются, выделяя дисперсную фазу при укрупнении частиц под действием межмолекулярных сил сцепления, переходя в I группу примесей.Гидрофильные коллоиды взаимодействуют с дисперсной средой и способны растворяться в ней. Фактически они представляют собой устойчивые растворы высокомолекулярных соединений с молекулярной массой 104–106 единиц.Коллоидные примеси природных вод представляют собой минеральные и органоминеральные частицы почв и грунтов, недиссоциированные и нерастворимые формы гумуса. Гумус вымывается из лесных, болотистых и торфяных почв или образуется в водоемах в результате жизнедеятельности растений и водорослей. Коллоиды содержатся также в большинстве сточных вод, особенно в стоках нефтехимических и целлюлозно-бумажных производств.Примеси коллоидной дисперсности имеют высокую удельную поверхность и обладают большой поверхностной энергией. С увеличением степени дисперсности растет количество молекул, находящихся на поверхности раздела фаз. Они расположены в несимметричном силовом поле и обладают избыточной свободной энергией из-за некомпенсированных молекулярных связей.Ко II группе примесей Кульский относит и вирусы. Они не способны существовать на питательных средах и размножаются только в клетках организма-хозяина.III группу примесей представляют органические соединения биологического и антропогенного происхождения — жиры, белки, углеводы, сахара, продукты жизнедеятельности бактерий, водорослей, человека и животных), фенолы, спирты, альдегиды и тому подобное, стоки химической промышленности, растворимые формы гумуса (фульвокислоты).
 Эти соединения практически недиссоциированы и представляют собой неэлектролиты. В результате взаимодействия с водой они образуют гидраты, а взаимодействуя между собой — ассоциаты. Эти соединения термодинамически устойчивы и могут существовать как угодно долго, не выделяясь из воды. При превышении определенной концентрации (предела растворимости) они образуют двухфазные системы (выпадают в осадок) и переходят в примеси первой группы.К этой группе относятся также минеральные соединения — растворенные газы. В природных водах, как правило, присутствуют кислород, азот, углекислый газ. Подземные воды могут содержать также сероводород. Эти газы также присутствуют в водах, где идут процессы гниения (хозяйственно-фекальные, болотные воды).Примеси IV группы представляют собой растворы солей, кислот и щелочей и являются электролитами. Они образуются в результате диссоциации молекул веществ с ионными или сильно полярными связями под влиянием полярной структуры молекул воды.В подавляющем количестве природных и сточных вод содержатся катионы кальция, магния, железа, натрия, калия, марганца, водородные ионы (ионы гидрониума Н3О + ), а также анионы: гидрокарбонаты (НСО3 — ), карбонаты (СО3 2- ), сульфаты (SO4 2- ), хлориды (Cl), фтор (F — ), фосфаты (PO4 3- ), нитраты (NO3 ), нитриты (NO2 — ), гидросиликаты (HSiO2 — ), гидроксильные группы OH — . Специфичные ионы содержатся в стоках гальванических производств, кожевенной и радиоэлектронной промышленности.В результате взаимодействия ионы могут образовывать мало- или недиссоциированные соединения (например, газ СО2, осадок Fe(OH)3) и переходить таким образом в примеси других групп.
Эти соединения практически недиссоциированы и представляют собой неэлектролиты. В результате взаимодействия с водой они образуют гидраты, а взаимодействуя между собой — ассоциаты. Эти соединения термодинамически устойчивы и могут существовать как угодно долго, не выделяясь из воды. При превышении определенной концентрации (предела растворимости) они образуют двухфазные системы (выпадают в осадок) и переходят в примеси первой группы.К этой группе относятся также минеральные соединения — растворенные газы. В природных водах, как правило, присутствуют кислород, азот, углекислый газ. Подземные воды могут содержать также сероводород. Эти газы также присутствуют в водах, где идут процессы гниения (хозяйственно-фекальные, болотные воды).Примеси IV группы представляют собой растворы солей, кислот и щелочей и являются электролитами. Они образуются в результате диссоциации молекул веществ с ионными или сильно полярными связями под влиянием полярной структуры молекул воды.В подавляющем количестве природных и сточных вод содержатся катионы кальция, магния, железа, натрия, калия, марганца, водородные ионы (ионы гидрониума Н3О + ), а также анионы: гидрокарбонаты (НСО3 — ), карбонаты (СО3 2- ), сульфаты (SO4 2- ), хлориды (Cl), фтор (F — ), фосфаты (PO4 3- ), нитраты (NO3 ), нитриты (NO2 — ), гидросиликаты (HSiO2 — ), гидроксильные группы OH — . Специфичные ионы содержатся в стоках гальванических производств, кожевенной и радиоэлектронной промышленности.В результате взаимодействия ионы могут образовывать мало- или недиссоциированные соединения (например, газ СО2, осадок Fe(OH)3) и переходить таким образом в примеси других групп.